- Очаговая лейкоцитарная инфильтрация что это значит
- Очаговая лейкоцитарная инфильтрация что это значит
- Цитологическая диагностика заболеваний шейки матки
- Получение материала
- Приготовление препаратов
- Интерпретация результатов цитологического исследования
- Лимфоцитарная инфильтрация Джесснера-Канофа
- Общие сведения
- Причины лимфоцитарной инфильтрации
- Симптомы лимфоцитарной инфильтрации
- Диагностика лимфоцитарной инфильтрации
- Лечение лимфоцитарной инфильтрации
Очаговая лейкоцитарная инфильтрация что это значит
Цель исследования — выявить зависимость площади распространения, характера и клеточного состава лейкоцитарных инфильтратов от степени заселенности хеликобактером, активности гастрита, стадии эпителиальной метаплазии слизистой оболочки желудка. Данные характеристики лейкоцитарных инфильтратов определяли в биоптатах желудка, взятых во время гастродуоденоскопического обследования при гастритах и хеликобактерном поражении 0, 1, 2, 3 степени, а также метаплазии эпителия низкой и высокой степени, при окраске гистологическими и гистохимическими методами. Оценивали площадь инфильтратов по программе «Bio Vizion» с использованием цифрового окуляра USB 5,0. Подсчитывали различные клеточные формы на 500 лейкоцитов, проводили статистическую обработку данных при помощи программы StatSoft 6.0.
Выявлено, что при гастритах преобладает диффузная инфильтрация собственной пластинки слизистой оболочки. С увеличением активности заболевания замечен рост площади диффузной инфильтрации от малой при 1-ой степени активности до средней и высокой — при 3-ей степени. По мере увеличения активности заболевания в инфильтратах возрастает содержание эозинофилов, бластных форм, проплазмоцитов и плазмоцитов, среди лимфоцитов преобладающими становятся активированные формы. Клеточный состав лейкоцитарных инфильтратов изменяется и в зависимости от степени заселенности желудка хеликобактером: с увеличением степени хеликобактерной инфекции в диффузных клеточных инфильтратах возрастает число бластных клеток, проплазмоцитов и плазмоцитов. При хеликобактериозе 2-ой и 3-ей степени в собственной пластинке слизистой оболочки желудка появляется очаговая лейкоцитарная инфильтрация, изменение клеточного состава которой имеет такую же закономерность, как и диффузных. Метапластические процессы в желудке сопровождаются появлением как диффузной, так и очаговой лейкоцитарной инфильтрации. При низкой степени метаплазии — диффузная инфильтрация малой и средней величины, а при высокой — диффузная и очаговая средней степени выраженности. При высокой степени метаплазии лимфоциты инфильтратов носят, в основном, активированный характер. Количество бластов, проплазмоцитов и плазмоцитов увеличивается с повышением степени метаплазии и в диффузных, и в очаговых инфильтратах. Итак, лейкоцитарные инфильтраты отличаются характером, площадью распространения и клеточным составом в зависимости от типа предракового состояния и степени активности патологического процесса в желудке. Следовательно, их характеристика может служить одним из важных показателей патологии органа и контролировать дальнейшее развитие заболевания.
Источник
Очаговая лейкоцитарная инфильтрация что это значит
Истинным предраковым изменением слизистой оболочки желудка считается дисплазия эпителия. Выделяют три степени дисплазии: слабую, умеренную и выраженную. Наиболее опасной в плане трансформации в рак желудка считается тяжелая дисплазия эпителия. В настоящее время в классификации оставлены только две степени — слабая и тяжелая. Известно, что дисплазия — это истинная неоплазия, только без признаков инвазии. Дисплазией названы гистологические изменения эпителия, предшествующие развитию рака. Она может наблюдаться как в покровно-ямочном и шеечном, так и в метаплазироваином эпителии кишечного типа слизистой оболочки желудка. Для дисплазии эпителия характерны нарушение гистоархитектоники слизистой оболочки, клеточная атипия и снижение дифференцировки клеток. Признаками нарушения структуры слизистой оболочки являются нарушение формы желез, их ветвление, почкование, тесное расположение. Клеточная атипия эпителия проявляется полиморфизмом, гиперхромностью ядер, увеличением ядерно-цитоплазматического соотношения; снижение дифференцировки клеток — уменьшением секреции, исчезновением дифференцированных клеток (главных, париетальных), а при кишечной метаплазии — уменьшением числа бокаловидных и клеток Панета вплоть до их полною исчезновения.
Цель работы — выявить площадь распространённости, характер и клеточный состав лейкоцитарных инфильтратов при различной степени эпителиальной дисплазии слизистой оболочки желудка.
Определяли степень и характер распространения лейкоцитарных инфильтратов в слизистой оболочке желудка, его клеточный состав при дисплазии эпителия низкой и высокой степени. Исследовали биоптаты желудка, взятые во время гастродуоденоскопического обследования. Парафиновые срезы окрашивали гистологическими и гистохимическими методами. Оценивали площадь инфильтратов по программе «Bio Vizion» с использованием цифрового окуляра USB 5,0. Подсчитывали различные клеточные формы на 500 лейкоцитов, проводили статистическую обработку данных при помощи программы StatSoft 6.0.
Диспластические процессы в желудке сопровождаются появлением как диффузной, так и очаговой лейкоцитарной инфильтрации. При низкой степени дисплазии — диффузная инфильтрация малой и средней величины, а при высокой — лишь средней степени выраженности. При низкой степени дисплазии в инфильтратах преобладают неактивированные лимфоциты, при высокой степени — в основном, активированные. И в том, и в другом случае много макрофагов и эозинофилов. Количество бластов, проплазмоцитов и плазмоцитов увеличивается с повышением степени дисплазии. В очаговых инфильтратах по мере повышения степени дисплазии также увеличивается содержание бластов, проплазмоцитов и плазмоцитов.
Таким образом, различные предраковые состояния желудка отличаются разным характером лейкоцитарной инфильтрации. Распространённость инфильтратов зависит от степени активности патологического процесса. Также изменяется клеточный состав лейкоцитарных инфильтратов: по мере повышения степени дисплазии в них увеличивается количество бластов, активированных лимфоцитов, проплазмоцитов и плазмоцитов. Следовательно, характер, распространённость и клеточный состав лейкоцитарных инфильтратов при предраковых состояниях желудка служит важной характеристикой данных патологических процессов.
Источник
Цитологическая диагностика заболеваний шейки матки
Цитологическое исследование мазков из шейки матки позволяет оценить состояние слизистой оболочки, наличие или отсутствие признаков патологических процессов (реактивных, предопухолевых, опухолей). При выявлении другими лабораторными методами инфекционного агента (вирус папилломы человека, бактериальные и паразитарные инфекции), цитологический метод позволяет оценить реакцию организма на инфекционный агент, наличие или отсутствие признаков повреждения, пролиферации, метаплазии или трансформации эпителия. Возможно также при исследовании мазка определить причину изменений эпителия (наличие воспаления с ориентировочным или уверенным определением патогенной микробиоты (микрофлоры), патологических процессов, связанных с гормональным, лекарственным, механическим, лучевым воздействием на организм женщины и шейку матки, состояний, чреватых опасностью возникновения дисплазии и рака шейки матки, а при их развитии установить правильный диагноз. В связи с этим цитологическое исследование применяют как при скрининге (мазки с визуально нормальной шейки матки), так и при наличии видимых при гинекологическом осмотре изменений слизистой оболочки.
Получение материала
Рак шейки матки чаще всего развивается в зоне трансформации, ему предшествуют фоновые процессы и внутриэпителиальные поражения (дисплазия эпителия), которые могут располагаться на небольших участках, поэтому важно, чтобы материал был получен со всей поверхности шейки матки, особенно из зоны стыка плоского и цилиндрического эпителия. Число измененных клеток в мазке бывает различным, и если их мало, то увеличивается вероятность, что патологические изменения могут быть пропущены при просмотре препарата. Для эффективного цитологического исследования необходимо учитывать:
- при профилактических осмотрах цитологические мазки следует брать у женщин независимо от жалоб, наличия или отсутствия изменений слизистой оболочки. Цитологическое исследование следует повторять не реже, чем раз в три года;
- желательно получать мазки не ранее, чем на 5-е сутки менструального цикла и не позднее, чем за 5 суток до предполагаемого начала менструации;
- нельзя брать материал в течение 48 ч после полового контакта, использования любрикантов, раствора уксуса или Люголя, тампонов или спермицидов, спринцевания, введения во влагалище медикаментов, свечей, кремов, в т. ч. кремов для выполнения ультразвукового исследования;
- беременность – не лучшее время для скрининга, так как возможны неправильные результаты, но, если нет уверенности, что женщина придет на обследование после родов, лучше мазки взять;
- при симптомах острой инфекции желательно получать мазки с целью обследования и выявления патологических изменений эпителия, этиологического агента; также необходим цитологический контроль после лечения, но не ранее, чем через 2 мес. после окончания курса.
Материал из шейки матки должен брать врач-гинеколог или (при скрининге, профилактическом осмотре) хорошо обученная медицинская сестра (акушерка).
Важно, чтобы в мазок попадал материал из зоны трансформации, так как около 90% опухолей исходит из зоны стыка плоского и цилиндрического эпителия и зоны трансформации и только 10% из цилиндрического эпителия цервикального канала.
С диагностической целью материал получают раздельно из эктоцервикса (влагалищной порции шейки матки) и эндоцервикса (цервикального канала) с помощью шпателя и специальной щетки (типа Cytobrush). При проведении профилактического осмотра используют Cervex-Brush, различные модификации шпателя Эйра и другие приспособления для получения материала одновременно из влагалищной части шейки матки, зоны стыка (трансформации) и цервикального канала.
Перед получением материала шейку матки обнажают в “зеркалах”, дополнительных манипуляций не проводят (шейку не смазывают, слизь не удаляют; если слизи много – ее аккуратно снимают ватным тампоном, не надавливая на шейку матки.). Щетку (шпатель Эйра) вводят в наружный зев шейки матки, осторожно направляя центральную часть приспособления по оси цервикального канала. Далее ее наконечник поворачивают на 360° (по часовой стрелке), достигая тем самым получения достаточного числа клеток из эктоцервикса и из зоны трансформации. Введение инструмента выполняют очень бережно, стараясь не повредить шейку матки. Затем щетку (шпатель) выводят из канала.
Приготовление препаратов
Перенос образца на предметное стекло (традиционный мазок) должен происходить быстро, без подсушивания и потери прилипших к инструменту слизи и клеток. Обязательно перенести на стекло материал с обеих сторон шпателя или щетки.
Если предполагается приготовление тонкослойного препарата с помощью метода жидкостной цитологии, головку щетки отсоединяют от ручки и помещают в контейнер со стабилизирующим раствором.
Фиксация мазков выполняется в зависимости от предполагаемого метода окрашивания.
Окрашивание по Папаниколау и гематоксилин-эозином наиболее информативны в оценке изменений эпителия шейки матки; любая модификация метода Романовского несколько уступает этим методам, однако при наличии опыта позволяет правильно оценить и характер патологических процессов в эпителии и микрофлору.
Клеточный состав мазков представлен слущенными клетками, находящимися на поверхности эпителиального пласта. При адекватном получении материала с поверхности слизистой оболочки шейки матки и из цервикального канала в мазок попадают клетки влагалищной порции шейки матки (многослойный плоский неороговевающий эпителий), зоны стыка или трансформации (цилиндрический и, при наличии плоскоклеточной метаплазии, метаплазированный эпителий) и клетки цервикального канала (цилиндрический эпителий). Условно клетки многослойного плоского неороговевающего эпителия принято делить на четыре типа: поверхностные, промежуточные, парабазальные, базальные. Чем лучше выражена способность эпителия к созреванию, тем более зрелые клетки попадают в мазок. При атрофических изменениях на поверхности эпителиального пласта расположены менее зрелые клетки.
Интерпретация результатов цитологического исследования
Наиболее распространенная в настоящее время – классификация Bethesda (The Bethesda System), разработанная в США в 1988 г, в которую вносили несколько изменений. Классификация создана для более эффективной передачи информации из лаборатории врачам клинических специальностей и обеспечения стандартизации лечения диагностированных нарушений, а также последующего наблюдения за больными.
В классификации Bethesda выделяют плоскоклеточные интраэпителиальные поражения низкой и высокой степени (squamous intraepithelial lesions of low grade and high grade – LSIL и HSIL) и инвазивный рак. Плоскоклеточные интраэпителиальные поражения низкой степени включают изменения, связанные с папилломавирусной инфекцией и слабой дисплазией (CIN I), высокой степени – умеренную дисплазию (CIN II), тяжелую дисплазию (CIN III) и внутриэпителиальный рак (cr in situ). В этой классификации имеются также указания на специфические инфекционные агенты, вызывающие заболевания, передавае мые половым путем.
Для обозначения клеточных изменений, которые трудно дифференцировать между реактивными состояниями и дисплазией предложен термин ASCUS – atypical squamous cells of undetermined significance (клетки плоского эпителия с атипией неясного значения). Для клинициста этот термин мало информативен, однако он нацеливает врача на то, что данная пациентка нуждается в обследовании и/или в динамическом наблюдении. В классификацию Bethesda в настоящее время введен также термин NILM – no intraepithelial lesion or malignancy, объединяющий норму, доброкачественные изменения, реактивные изменения.
Так как данные классификации используются в практике врача-цитолога, ниже приведены параллели между классификацией Bethesda и классификацией, распространенной в России (Табл. 22). Цитологическое стандартизованное заключениепо материалу из шейки матки (форма № 446/у), утверждено приказом Минздрава России от 24.04.2003 № 174.
Причины получения неполноценного материала различны, поэтому цитолог перечисляет типы клеток, обнаруженные в мазках и по возможности указывает причину, по которой материал признан неполноценным.
Источник
Лимфоцитарная инфильтрация Джесснера-Канофа
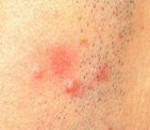
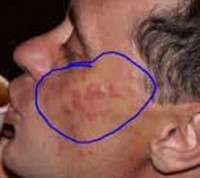
Лимфоцитарная инфильтрация Джесснера-Канофа – редкий хронический дерматоз, характеризующийся доброкачественной инфильтрацией кожи лимфоцитами. Заболевание имеет волнообразное течение, склонно к саморазрешению. Клинически проявляется высыпанием на неизменённой коже плоских гладких синюшно-розовых бляшек или папул, которые сливаются в очаги величиной с ладонь ребенка или взрослого. Первичные элементы имеют чёткие границы, шелушатся. Бляшки обычно единичные, располагаются на лице, шее, туловище, конечностях. Диагностируется клинически с гистологическим подтверждением, иногда проводят молекулярно-биологические исследования. Лечение – НПВС, гормональная терапия, препараты местного действия.
Общие сведения
Лимфоцитарная инфильтрация Джесснера-Канофа – доброкачественная псевдолимфома кожи с хроническим волнообразным рецидивирующим течением. Встречается редко. Чаще возникает у мужчин старше 20 лет. Сезонных, расовых различий не имеет, не эндемична. Иногда наблюдается улучшение в летний период. Впервые данная патология была описана в 1953 году, когда М. Джесснер и Н. Каноф рассмотрели ее как самостоятельное заболевание со сквозной инфильтрацией лимфоцитами всех слоёв дермы. Название «псевдолимфома» в 1965 году ввел К. Мач, объединивший инфильтрацию Джесснера-Канофа в одну группу с другими разновидностями лимфоцитарной инфильтрации.
В 1975 году О. Браун отдифференцировал тип заболевания, отнеся инфильтрацию лимфоцитами к В-клеточным псевдолимфомам, однако позже специалисты стали рассматривать патологию как Т-псевдолимфому. Именно Т-лимфоциты обеспечивают доброкачественное течение патологии и возможность спонтанной инволюции первичных элементов. Дальнейшие исследования показали, что в возникновении и течении лимфоцитарной инфильтрации Джесснера существенную роль играет иммунная система организма. Возможно, это связано с тем, что клетки иммунной системы располагаются в пищеварительном тракте, а он поражается в 70% случаев заболевания. Изучение лимфоцитарной инфильтрации Джесснера-Канофа продолжается и в настоящее время. Понимание причин возникновения и развития Т-лимфоидных процессов имеет большое значение в разработке патогенетического лечения псевдолимфом.
Причины лимфоцитарной инфильтрации
Наиболее вероятными причинами лимфоцитарной инфильтрации Джесснера-Канофа принято считать гиперинсоляцию, укусы клещей, инфекции, патологию желудочно-кишечного тракта, использование дерматогенной косметики и нерациональный приём лекарственных препаратов, провоцирующих системные иммунные нарушения, визуально представленные инфильтративными изменениями в коже. Механизм лимфоцитарной инфильтрации Джесснера-Канофа заключается в следующем: интактный эпидермис даёт Т-лимфоцитам возможность инфильтрировать глубокие слои дермы, располагаясь в сосочковых выростах и вокруг сосудистых сплетений по всей толще кожи. Триггеры заболевания запускают воспаление, на которое реагируют непосредственно клетки кожи и клетки иммунной системы. В процесс купирования воспаления включаются Т-лимфоциты, обеспечивающие доброкачественный ответ иммунной системы в виде пролиферации эпителиальных клеток дермы.
Одновременно в коже развивается банальное воспаление, проходящее три стадии: альтерации, экссудации и пролиферации с участием гистиоцитов – клеток ретикулярной ткани. Гистиоциты группируются и образуют островки, напоминающие лимфоидные фолликулы. На конечном этапе купирования воспаления два параллельных процесса пролиферации дополняют и усиливают друг друга. Так возникает очаг лимфоцитарной инфильтрации. Поскольку лимфоциты гетерогенны, оценка их гистохимических свойств с помощью иммунологических маркеров и моноклональных антител легла в основу иммунофенотипирования. Этот анализ имеет большое диагностическое значение в современной дерматологии.
Симптомы лимфоцитарной инфильтрации
Первичным элементом кожной сыпи при лимфоцитарной инфильтрации Джесснера-Канофа является крупная плоская розово-синюшная бляшка или папула с чёткими границами и гладкой поверхностью, имеющая тенденцию к периферическому росту. Сливаясь между собой, первичные элементы образуют кольцевидные или дугообразные «острова» с участками шелушения. Разрешение высыпавших элементов начинается с центра, поэтому сливные очаги могут иметь западание в центральной части. Типичной локализацией принято считать лицо, шею, околоушное пространство, затылок, лоб, щёки и скулы. Редко высыпания появляются на коже туловища и конечностях. Обычно первичный элемент одиночный, реже наблюдается тенденция к распространению процесса.
Лимфоцитарная инфильтрация Джесснера-Канофа характеризуется волнообразным рецидивирующим течением. Резистентна к проводимой терапии, способна спонтанно саморазрешаться. Рецидивы обычно возникают в местах прежней локализации, но могут захватывать и новые участки кожного покрова. Несмотря на длительное хроническое течение, внутренние органы в процесс не вовлекаются.
Диагностика лимфоцитарной инфильтрации
Заболевание диагностируется дерматологом на основании анамнеза, клиники, гистологии и люминесцентного микроскопирования (типичное свечение на границе дермоэпидермального соединения не определяется) с обязательной консультацией иммунолога и онколога. Гистологически при лимфоцитарной инфильтрации Джесснера-Канофа выявляется неизменённый поверхностный слой кожи. В толще дермальных слоёв обнаруживается группирование лимфоцитов и клеток соединительной ткани вокруг сосудов.
В сложных случаях проводят иммунотипирование опухоли, гистохимическое и молекулярное тестирование. К. Фан с соавторами рекомендуют основывать диагностику на результатах ДНК-цитофлюориметрии с анализом количества нормальных клеток (при лимфоцитарной инфильтрации Джесснера-Канофа более 97%). Дифференциальную диагностику проводят с саркоидозом, системной красной волчанкой, центробежной эритемой Биетта, кольцевидной гранулёмой, группой лимфоцитарных опухолей, токсикодермией и сифилисом.
Лечение лимфоцитарной инфильтрации
Лечение направлено на купирование острой фазы лимфоцитарной инфильтрации Джесснера-Канофа и увеличение продолжительности светлых промежутков. Терапия патологии неспецифическая. Отмечается хороший терапевтический эффект при назначении антималярийных препаратов (хлорохин, гидроксихлорохин) и нестероидных противовоспалительных средств (диклофенак, индометацин) после предварительного лечения сопутствующей патологии желудочно-кишечного тракта. Если состояние пищеварительной системы позволяет, применяют энтеросорбенты. Местно показаны гормональные кортикостероидные мази и кремы, а также инъекционные блокады очагов высыпаний триамцинолоном и бетаметазоном. При резистентности к проводимой терапии подключают плазмаферез (до 10 сеансов).
Источник